Approvata in Italia la rimborsabilità di polatuzumab vedotin di Roche per il trattamento di pazienti adulti con linfoma diffuso a grandi cellule B (DLBCL) recidivante o refrattario (R/R) non candidabili a trapianto
I Linfomi Non Hodgkin (NHL) sono un gruppo eterogeneo di neoplasie ematologiche. Il Linfoma Diffuso a Grandi Cellule B (DLBCL) è il sottotipo più comune, è aggressivo, a rapida progressione e, in circa il 40% dei pazienti, recidiva o mostra refrattarietà ai trattamenti. La presenza di malattia recidivata o refrattaria rappresenta una delle principali cause di morbilità e mortalità [1].
Oggi, per i pazienti italiani colpiti dalla patologia, è disponibile una nuova opzione terapeutica. Polatuzumab vedotin, in associazione a bendamustina e rituximab, è indicato per il linfoma diffuso a grandi cellule B (DLBCL) recidivante o refrattario, in soggetti adulti non candidabili al trapianto di cellule staminali ematopoietiche. Lo studio randomizzato di fase Ib/II GO293652 ha dimostrato una riduzione del rischio di morte del 58% nei pazienti trattati con polatuzumab vedotin in associazione a bendamustina e rituximab rispetto al trattamento con bendamustina e rituximab (BR) e la sopravvivenza globale (OS) mediana è stata oltre 2,5 volte superiore (12,4 mesi per la combinazione rispetto ai 4,7 mesi dei pazienti trattati solo con BR).
Presentati, inoltre, all’ultimo Congresso dell’American Society of Hematology (ASH), i risultati di dello studio di fase 3 POLARIX: per la prima volta dopo oltre 20 anni di tentativi, la combinazione di polatuzumab vedotin con il regime immuno-chemioterapico R-CHP ha dimostrato un miglioramento clinico significativo, aumentando la probabilità di curare i pazienti già dalla prima linea di terapia.
Monza, 17 gennaio 2022– Con la pubblicazione in Gazzetta Ufficiale della determina che ne ammette la rimborsabilità da parte del Servizio Sanitario Nazionale [2], è da oggi rimborsato in Italia polatuzumab vedotin, in associazione a bendamustina e rituximab, per il trattamento di pazienti adulti con linfoma diffuso a grandi cellule B (DLBCL) recidivante o refrattario, non candidabili al trapianto di cellule staminali ematopoietiche. La terapia è frutto della ricerca Roche.
I Linfomi Non Hodgkin” (NHL) sono un gruppo eterogeneo di neoplasielinfoproliferative, che hanno origine dal sistema emolinfopoietico [1;3]. Il Linfoma Diffuso a Grandi Cellule B (DLBCL) è il sottotipo istologico più comune di NHL, responsabile a livello mondiale del 30%-48% di tutti i casi di NHL e del 60% dei linfomi aggressivi [1;3;4;5]. Il DLBCL in genere si manifesta in persone di età superiore ai 60 anni, l’incidenza aumenta con l’età e l’età mediana alla diagnosi è compresa tra 64 e 74 anni [1;3]. In Italia, si stima un’incidenza annua di circa 5mila nuovi casi DLBCL [3].
I pazienti affetti da questa tipologia di linfoma presentano una prognosi infausta, sia nel caso in cui non vi sia mai stata una risposta alla terapia (malattia refrattaria), sia nel caso in cui vi sia stata una ricaduta (malattia recidivata). La terapia standard di prima linea per i pazienti non ad alto rischio, il regime immuno-chemioterapico R-CHOP (rituximab in associazione a ciclofosfamide, adriamicina, vincristina e prednisone), è in grado di curare circa i 2/3 dei pazienti trattati. Dopo il fallimento della terapia in prima linea, per i pazienti in seconda linea che non sono eleggibili al trapianto di cellule staminali autologhe a causa dell’età, delle co-morbilità o della chemio-refrattarietà e per tutti i pazienti oltre la seconda linea, l’approccio terapeutico è prevalentemente di tipo contenitivo. Per questi pazienti gli outcome clinici sono sfavorevoli, con una sopravvivenza globale (OS) mediana di circa 6 mesi [3;4;5]. Inoltre, i pazienti primariamente refrattari che progrediscono durante la terapia di prima linea, ottengono risultati molto scarsi anche dopo aver ricevuto un ulteriore trattamento seguito da un trapianto autologo, con un tasso di sopravvivenza libera da progressione a 3 anni (PFS) del 17% [3].
Si configura quindi un bisogno clinico rilevante per questo profilo di pazienti, per i quali l’approvazione di polatuzumab vedotin rappresenta una svolta. “La rimborsabilità di polatuzumab vedotin in associazione a bendamustina e rituximab assume particolare rilevanza perché offre un’arma terapeutica innovativa proprio a pazienti fragili che, non rispondendo alle prime linee di trattamento o vivendo la ricomparsa della malattia, convivono con uno stato di profonda ansia e disillusione. Per questi pazienti in particolare l’attenzione alla qualità di vita e all’aspetto psicologico è indispensabile nella presa in carico – ha dichiarato Davide Petruzzelli, Presidente La Lampada di Aladino Onlus – Nell’ambito dei tumori del sangue stiamo assistendo a significativi passi avanti, e notizie come questa necessitano di essere condivise, grazie anche al supporto dei media, affinché i pazienti possano essere informati e valutare, insieme al proprio medico specialista, tutte le possibili opzioni in grado di migliorare il proprio percorso terapeutico”.
L’efficacia di polatuzumab vedotin in combinazione con bendamustina e rituximab nei pazienti con DLBCL non candidabili al trapianto con cellule staminali è stata dimostrata nello studio di fase Ib/II GO29365, una sperimentazione internazionale e multicentrica volta a valutare l’efficacia, la sicurezza e la tollerabilità dell’associazione3. I risultati attestano una riduzione del rischio di morte del 58% nei pazienti trattati con polatuzumab vedotin in associazione a bendamustina e rituximab rispetto al trattamento con bendamustina e rituximab (BR) e una sopravvivenza globale (OS) mediana oltre 2,5 volte superiore (12,4 mesi per la combinazione rispetto ai 4,7 mesi dei pazienti trattati solo con BR). I dati della coorte di estensione composta da ulteriori 106 pazienti trattati con polatuzumab vedotin in combinazione a BR, rafforzano il profilo di efficacia e sicurezza della terapia in una popolazione più ampia di pazienti, dimostrato maggior beneficio nella seconda linea di trattamento, una sopravvivenza globale mediana di 18.4 mesi, una sopravvivenza libera dalla progressione mediana di 11.5 mesi. “Polatuzumab vedotin in associazione a bendamustina e rituximab rappresenta una nuova ed efficace opzione di trattamento per pazienti affetti da Linfoma Diffuso a Grandi Cellule B che ricadono o risultano refrattari ad una terapia di prima linea e che non possono affrontare un trapianto di cellule staminali, così come per quelli che recidivano dopo trapianto. Parliamo quindi di un gruppo di pazienti con prognosi molto infausta, per i quali fino ad oggi le alternative terapeutiche disponibili portavano a risultati decisamente deludenti – ha dichiarato la Dott.ssa Monica Balzarotti, Oncoematologa presso l’IRCCS Istituto Clinico Humanitas di Milano – Grazie ad un profilo di sicurezza accettabile, ad una buona maneggevolezza e a dati di efficacia supportati da evidenze solide, la comunità degli ematologi e dei pazienti con DLBCL può disporre di un’arma terapeutica aggiuntiva, che ha il potenziale di migliorare in modo significativo le attuali strategie di cura, consentendo di ottenere un aumento delle remissioni complete e della loro durata, e in ultima analisi della sopravvivenza”.
Se l’approvazione italiana sancisce un importante passo avanti in un’area ad elevato unmet need, il passo successivo e auspicato è che la molecola possa portare i suoi benefici ad una popolazione ancora più ampia di pazienti colpiti da DLBCL, ottenendo anche l’indicazione in prima linea. Presentati, su questo fronte, all’ultimo Congresso dell’American Society of Hematology (ASH) tenutosi a Dicembre 2021, i risultati dello studio di fase 3 POLARIX, che ha messo a confronto polatuzumab vedotin in combinazione con rituximab più ciclofosfamide, doxorubicina e prednisone (R-CHP) rispetto all’attuale standard di cura della prima linea, che prevede la compinazione di rituximab più ciclofosfamide, doxorubicina, vincristina e prednisone (R-CHOP). Durante la Late-Breaking Abstracts Session del Congresso sono state infatti illustrate le evidenze che dimostrano come polatuzumab vedotin, in combinazione con il regime chemioterapico R-CHP, rappresenti il primo trattamento che in 20 anni ha portato un beneficio clinico significativo con una riduzione del rischio di progressione della patologia o morte del 27%, in pazienti con un rischio intermedio e alto in prima linea. Il profilo di safety della combinazione Pola-R-CHP è risultato in linea con quello del noto R-CHOP. L’endpoint primario è stato quindi raggiunto, consentendo alla ricerca Roche di compiere un importante passo avanti verso l’obiettivo di offrire al più ampio numero di pazienti con DLBCL concrete prospettive di guarigione.
“È grazie alla ricerca scientifica se oggi è possibile fare significativi passi avanti nel trattamento di patologie complesse e aggressive che presentano importanti bisogni insoddisfatti per chi ne soffre come il linfoma diffuso a grandi cellule B. È necessario, però, che le innovazioni messe a disposizione dai progressi scientifici vengano rese accessibili in tempi rapidi ai pazienti, offrendo così maggiori opportunità terapeutiche rispetto al passato, soprattutto nei casi in cui le alternative disponibili sono limitate – ha dichiarato il Prof. Sergio Amadori, Presidente dell’Associazione Italiana contro i linfomi, le leucemie e il mieloma (AIL) – La nostra associazione è impegnata per essere ogni giorno al fianco dei pazienti colpiti da linfomi e malattie onco-ematologiche e delle loro famiglie, affinché i percorsi di diagnosi, cura e assistenza possano essere sempre più tempestivi e capaci di offrire significativi miglioramenti in termini di sopravvivenza libera dalla malattia e qualità di vita”.
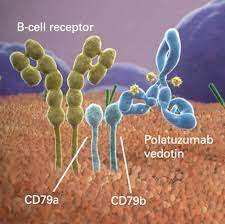
Polatuzumab vedotin è un anticorpo farmaco-coniugato (ADC) anti-CD79b, capostipite della sua classe. La proteina CD79b è espressa specificamente nella maggior parte delle cellule B, una cellula immunitaria da cui originano alcuni tipi di linfoma non-Hodgkin (NHL), e questo la rende un target promettente per lo sviluppo di nuove terapie. Polatuzumab vedotin si lega a CD79b e distrugge queste cellule B tramite la somministrazione mirata di un agente antitumorale, minimizzando così gli effetti sulle cellule normali.[9,10] Polatuzumab vedotin è in via di sviluppo da parte di Roche mediante la tecnologia Seattle Genetics ADC, ed è attualmente sottoposto a studio per il trattamento dei NHL. Polatuzumab vedotin viene commercializzato negli Stati Uniti da Genentech come Polatuzumab vedotin-piiq, con piiq come suffisso designato in accordo con le Linee guida per le aziende per la denominazione non proprietaria dei farmaci biologici emesse dalla Food and Drug Administration statunitense.
Il linfoma diffuso a grandi cellule B (DLBCL)
Il DLBCL è la più comune forma di linfoma non-Hodgkin (NHL) e rappresenta circa un caso su tre di NHL.[11] Il DLBCL è un tipo di NHL aggressivo (a rapida crescita).[12] Sebbene di norma risponda al trattamento di prima linea, la malattia diventa recidivante o refrattaria in una percentuale fino al 40% dei pazienti, e, quando questo si verifica, le opzioni terapeutiche sono limitate e la sopravvivenza è breve.[12] Si stima che ogni anno vengano diagnosticati nel mondo circa 150.000 nuovi casi di DLBCL.[13]
Lo studio clinico GO29365
GO29365 [NCT02257567] è uno studio globale, di fase Ib/II che ha valutato la sicurezza, la tollerabilità e l’attività di polatuzumab vedotin in combinazione a bendamustina e rituximab (BR) o obinutuzumab nel linfoma follicolare recidivato o refrattario (R/R) e nel linfoma diffuso a grandi cellule B (DLBCL). I pazienti eleggibili non erano candidabili al trapianto di cellule staminali ematopoietiche all’ingresso dello studio. La parte di fase II dello studio ha randomizzato 80 pazienti affetti da R/R DLBCL pesantemente pretrattati, a ricevere o BR o BR in combinazione con polatuzumab vedotin per una durata fissa di sei cicli di 21 giorni. Dei pazienti arruolati, l’80% aveva una malattia refrattaria. L’endpoint primario era il tasso di risposta completa (CR) alla fine del trattamento, misurata mediante tomografia ad emissione di positroni (PET-CT) e valutata da un comitato di revisione indipendente (IRC). Gli endpoint secondari includevano il tasso di risposta globale (ORR; CR e risposta parziale) valutato dello sperimentatore e il miglior ORR alla fine del trattamento valutato dallo sperimentatore e dall’IRC. Gli endpoint esplorativi includevano la durata della risposta, la sopravvivenza libera da progressione, la sopravvivenza libera da eventi e la sopravvivenza globale. In aggiunta alla coorte randomizzata dello studio, ulteriori 106 pazienti sono stati trattati con polatuzumab vedotin in combinazione con BR in una coorte di estensione a singolo braccio con il tasso di CR come endpoint primario.
Lo studio clinico POLARIX
POLARIX [NCT03274492] è uno studio internazionale di fase III, randomizzato, in doppio cieco, controllato con placebo che valuta l’efficacia, la sicurezza e la farmacocinetica di polatuzumab vedotin più rituximab, ciclofosfamide, doxorubicina e prednisone (R-CHP) rispetto a rituximab, ciclofosfamide, doxorubicina, vincristina e prednisone (R-CHOP) in pazienti con linfoma diffuso a grandi cellule B (DLBCL) precedentemente non trattato. 879 pazienti sono stati randomizzati 1:1 a ricevere polatuzumab vedotin più R-CHP più un placebo di vincristina, per sei cicli, seguiti da due cicli di rituximab; o R-CHOP più un placebo di polatuzumab vedotin per sei cicli, seguiti da due cicli di rituximab. L’endpoint primario è la sopravvivenza libera da progressione, valutata dallo sperimentatore utilizzando i criteri di risposta di Lugano. POLARIX è condotto in collaborazione con la Lymphoma Study Association (LYSA) e la Lymphoma Academic Research Organisation (LYSARC).
LYSA e LYSARC
La Lymphoma Study Association, o LYSA è il gruppo cooperatore per la ricerca sul linfoma in Europa e conduce studi clinici che vanno dai primi test di nuovi farmaci nell’uomo alla definizione di strategie terapeutiche di riferimento. LYSA include nella sua rete più di 120 centri di cura distribuiti in quattro Paesi (Francia, Belgio, Portogallo, Israele) e collabora con molti team scientifici a livello internazionale. La Lymphoma Academic Research Organisation, o LYSARC, è la struttura operativa di LYSA, che conduce progetti di ricerca clinica sui linfomi a livello internazionale.
Riferimenti
[1] Friedberg JW. Relapsed/refractory diffuse large B-cell lymphoma. Hematology Am Soc Hematol Educ Program. 2011;2011:498‐505.
[2] Gazzetta Ufficiale, https://www.gazzettaufficiale.it/eli/gu/2022/01/05/3/sg/pdf
[3] ClinicalTrials.gov identifier: NCT02257567
[4] Galaznik A et al. Systematic review of therapy used in relapsed or refractory diffuse large B-cell lymphoma and follicular lymphoma. Future Sci OA, 2018; 4, Fso322.
[5] Nogai HB et al. Pathogenesis of non-Hodgkin’s lymphoma. J Clin Oncol, 2011; 29, 1803-11.
[6] Al-Hamadani M et al. Non-Hodgkin lymphoma subtype distribution, geodemographic patterns, and survival in the US: A longitudinal analysis of the National Cancer Data Base from 1998 to 2011. Am J Hematol, 2015; 90, 790-5.
[7] Dornan D, et al. Therapeutic potential of an anti-CD79b antibody-drug conjugate, anti-CD79b-vc-MMAE, for the treatment of non-Hodgkin lymphoma. Blood 2009;114:2721-29.
[8] Pfeifer M, et al. Anti-CD22 and anti-CD79B antibody drug conjugates are active in different molecular diffuse large B-cell lymphoma subtypes. Leukemia 2015;29:1578-86.
[9] Ducry L, et al. Antibody-drug conjugates: linking cytotoxic payloads to monoclonal antibodies. Bioconjug Chem 2010;21:5-13.
[10] ADC Review. What are antibody-drug conjugates? [Internet; op.cit. luglio 2021]. Disponibile all’indirizzo: https://adcreview.com/adc-university/adcs-101/antibody-drug-conjugates-adcs/.
[11] World Health Organization Classification of Tumours of Haematopoietic and Lymphoid Tissues. IARC Press; 2008.
[12] Maurer JM, et al. Event-free survival at 24 months is a robust end point for disease-related outcome in diffuse large B-cell lymphoma treated with immunochemotherapy. J Clin Oncol 2014;32:1066-73.
[13] Globocan 2020. World Fact Sheet. [Internet; op.cit. luglio 2021]. Disponibile all’indirizzo: http://gco.iarc.fr/today/data/factsheets/populations/900-world-fact-sheets.pdf